Medición pH en suelos y la importancia de sus nutrientes

Un análisis conceptual sobre el crecimiento de las plantas y las condiciones del suelo proporciona una idea del efecto de propiedades químicas del suelo sobre el estado nutricional del suelo. Se ha observado que las reacciones del suelo juegan un papel fundamental papel en la determinación de la disponibilidad de nutrientes para las plantas. Siempre que se induzca acidez o basicidad en el suelo, solución, ciertas reacciones entran en juego por medio de las cuales cierta liberación, suministro e intercambio catiónicos y aniónicos intervienen entre plantas y suelos.
Palabras clave: pH, acidez, basicidad, nutrientes, suelo, etc.
Introducción
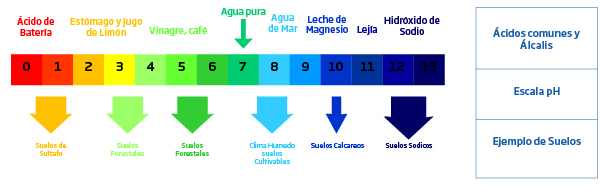
El pH del suelo es una medida de la acidez y alcalinidad de la solución del suelo. Puede definirse como el negativo logaritmo de la concentración de iones de hidrógeno [H+] o concentración de iones hidróxido [OH-], o simplemente, pH = -log [H+]; pH = -log [OH-]. Por referencia a la naturaleza ácida, neutra o alcalina, se puede proporcionar el valor de pH de los suelos. sobre la base de una escala que va de aproximadamente 0 a 14. Un valor de pH de 7 es neutro (agua pura), valores menos de 7 se refiere a ácido y por encima de 7 es alcalino. Al ser una función logarítmica, una unidad de una escala de pH es 10 veces más alcalino (o 10 veces más ácido) que la unidad debajo de él. Como ejemplo, si consideramos una solución de pH valor 4, tiene una concentración 10 veces mayor de OH- iones que una solución de pH 5 o 100 veces mayor concentración que una solución de pH 6. El efecto de los iones formadores de ácidos y bases. Influye en el pH del suelo. El efecto pronunciado sobre la acidez puede ser estimulado por cationes formadores de ácido como el hidrógeno(H+), aluminio (Al3+) y hierro (tanto Fe2+, Fe3+); mientras que la basicidad está influenciada por cationes formadores de bases como calcio (Ca2+), potasio (K+) y sodio (Na2+). Los suelos que tienen un rango de pH básico están asociados principalmente con presencia de cationes básicos junto con carbonatos y bicarbonatos del suelo y agua de riego. Además, la lixiviación limitada de cationes base debido a precipitaciones bajas puede actuar como un factor para el aumento relativo de valores de pH superiores a 7. Claramente las condiciones ácidas en el suelo están asociadas con áreas de alta precipitaciones y también con suelos que tienen materiales parentales de origen silícico. El aumento de las precipitaciones provoca mayor tasa de lixiviación de cationes base y, por lo tanto, se reduce el pH del suelo.
La principal fuente de nutrición humana se deriva principalmente del suelo. Un suelo bueno, fértil y productivo es una necesidad básica para desarrollar un ecosistema. Para mantener una productividad adecuada aspecto del suelo, es rudimentario que el suelo tenga una buena propiedad física y química, materia orgánica contenido, aireación adecuada con un pH y estado nutricional óptimos.
El químico y físico
La naturaleza del suelo determina el potencial del suelo para la capacidad de producción de cultivos. La naturaleza química del suelo incluye reacciones del suelo (pH), constitución de nutrientes, intercambio iónico, etc. El hecho es que la reacción del suelo (pH) no es un indicador de los atributos de crecimiento de las plantas; sin embargo, proporciona una buena indicación de varias plantas factores de crecimiento, principalmente para el estado de nutrientes del suelo. La disponibilidad de nutrientes en el suelo altamente asociada con el pH del suelo. La captación de iones como Ca2+ y Mg2+ por las plantas aumenta junto con el pH mientras la disponibilidad de micronutrientes aumenta con la disminución del pH del suelo. Más específicamente, el pH afecta la solubilidad química y disponibilidad de nutrientes vegetales esenciales junto con la descomposición de materia orgánica.
Desarrollo
Disponibilidad de nutrientes:
La capacidad de intercambio iónico CII.se ve afectada directamente por el pH del suelo. La capacidad de intercambio iónico es la capacidad del suelo, para retener, liberar y suministrar nutrientes a las plantas en forma de iones cargados positivamente. Los elementos químicos (o nutrientes de las plantas) en el suelo se produce como cationes (iones con carga +) o aniones (iones con carga -). La planta esencial nutrientes como H, Ca, Mg, Fe, N, K, P, Mn y Zn aparecen en el suelo como cationes. Otros iones disponibles son Na, Ba, Hg, Cd, Cr, etc. pero estos iones no son esenciales para las plantas.
Los suelos con alta capacidad de intercambio catiónico CIC. poseen una buena capacidad amortiguadora; que a su vez puede resistir cambios en pH. Los suelos arcillosos tienen una cantidad considerable de CIC que los suelos limosos o arenosos. En un alcalino (o básico) medio, la concentración de H+ iones es bajo; H+ Los iones competirán menos con el otro catión por el intercambio, sitios y más cationes base permanecerán en los sitios de intercambio de partículas.
Por tanto, los cationes son menos susceptibles a la lixiviación en condiciones alcalinas. Este proceso ocurre a la inversa en el medio ácido como H+ intercambios de iones los cationes base de los sitios de intercambio. Estos nutrientes se liberan en la solución del suelo que se toma por las plantas o incurrir en pérdidas por lixiviación.
Sin embargo, aunque una CIC adecuada es deseable para el crecimiento de los cultivos, no regula directamente el rendimiento del cultivo, factores. Las ventajas de tener una CIC alta son la retención de cationes de las pérdidas por lixiviación y la provisión de nutrientes esenciales de las raíces de las plantas a través del intercambio de H+ iones. La CEC se hace evidente a partir de minerales y materia orgánica a través de las cargas electrostáticas negativas. La materia orgánica inculca una CIC baja que puede aumentar cuando se descomponen y los residuos se convierten en humus. Este proceso lleva mucho tiempo que puede abarcar desde 5 años hasta algunos siglos. Entonces, las prácticas que pueden reducir se prefiere la erosión, las pérdidas por lixiviación y el mantenimiento de un buen contenido de materia orgánica en el suelo para la retención de la CIC.
Disponibilidad de nutrientes para las plantas:
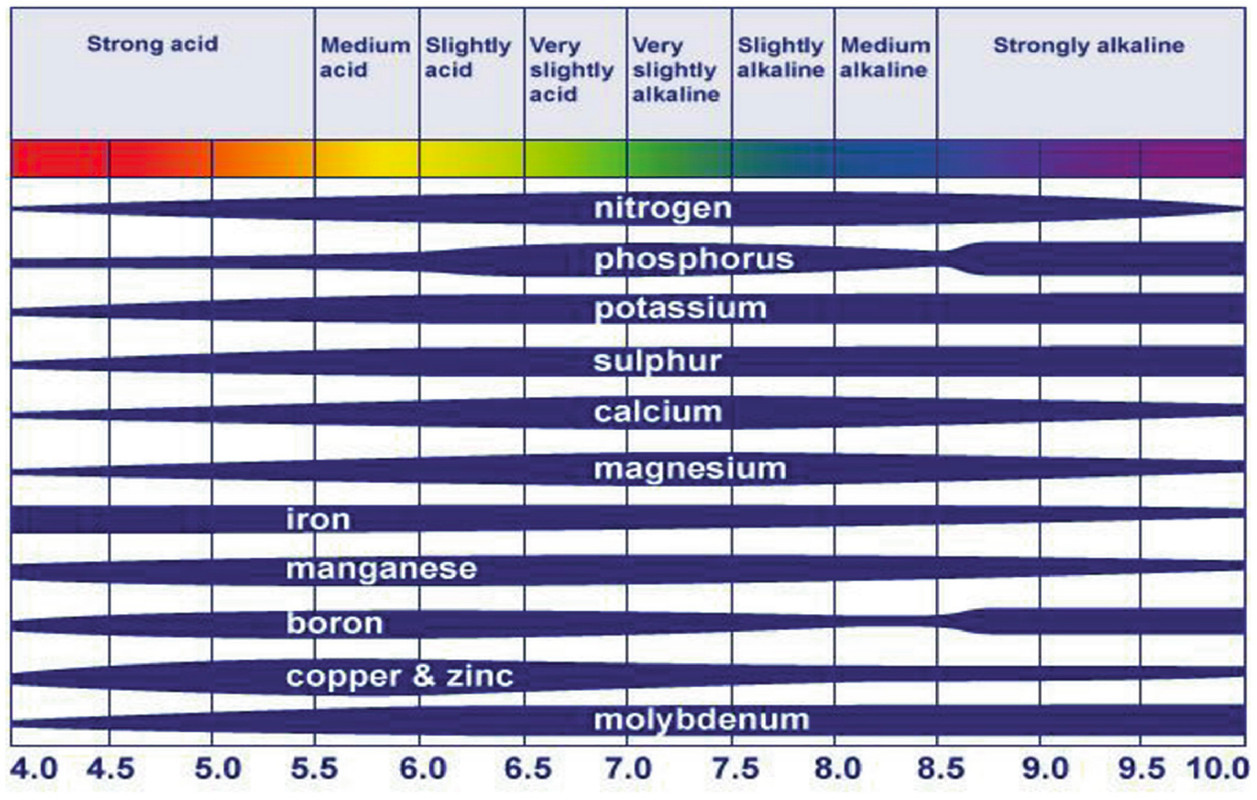
La disponibilidad de nutrientes vegetales esenciales está altamente correlacionada con la función del pH. Los nutrientes de las plantas son ampliamente clasificados como macronutrientes y micronutrientes según el requerimiento de la planta. Disponibilidad de estos nutrientes a las plantas corresponden a las condiciones diferenciales de pH. Los macronutrientes como el nitrógeno, calcio, potasio, magnesio y azufre, con el fósforo como excepción, están más fácilmente disponibles en un pH rango de 6.5-8. Sin embargo, los micronutrientes están disponibles ligeramente en un pH ligeramente ácido de 5-7. Estos son el rango óptimo en el que los nutrientes están disponibles para las plantas en cantidades favorables. La disponibilidad se vuelve menor fuera de estos rangos de pH.
A medida que el pH aumenta y se acerca a 8, los cationes se adhieren fuertemente al suelo y no son fácilmente intercambiables. Debido a esto, la disponibilidad de micronutrientes, además del molibdeno, disminuye en condiciones alcalinas. También, Los elementos nutritivos de Fe, Cu, Mn, Zn y Ni se unen estrechamente a pH alcalino y, por lo tanto, son más fáciles disponible en niveles de pH más bajos. Esto puede inducir síntomas de toxicidad a las plantas en suelos ácidos.
Crecimiento vegetal y acidez del suelo:
El crecimiento de las plantas puede verse afectado en gran medida por diferentes condiciones de pH. En condiciones ácidas, cierta situación puede surgir como toxicidad por metales. La población microbiana activa y su actividad involucrada en la inmovilización / mineralización de N, P y S puede verse obstaculizada. El calcio se vuelve deficiente en ácido las condiciones y la fijación simbiótica de N pueden verse muy afectadas. Además, los suelos ácidos que tienen poca materia orgánica.
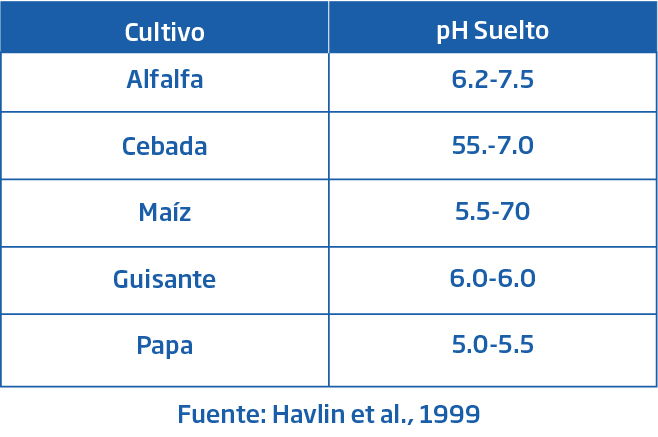
La selección de cultivos es muy recomendable para este tipo de condiciones. Generalmente, cultivos con alta tolerancia a pH ácido o básico se puede seleccionar. Por ejemplo, el cultivo de alfalfa puede crecer bien en un medio ácido de pH 6.2-7.5.
La cebada, el maíz y la avena pueden tolerar un pH tan bajo como 5,5. Las papas pueden crecer favorablemente en una condición de pH óptima de 5,0-5,5. A este pH, las bacterias que causan la enfermedad de la sarna común de las papas también pueden controlarse. Sin embargo, en las condiciones extremas de alta acidez o alcalinidad, pueden ser necesarias ciertas reformas de tal manera que los cultivos puedan crecer en condiciones óptimas. La Tabla 1 muestra algunos cultivos y su pH favorable del suelo.
Manejo del pH en suelos:
Suelos ácidos:
Un método comúnmente seguido para aumentar el pH del suelo es a través del proceso de encalado o precisamente la adición de materiales de encalado como CaCO3, CaO o Ca (OH)2. Se accede a la tasa de encalado según el tipo de suelos, profundidad de labranza y calidad de la piedra caliza. La dolomita es un sustituto barato de materiales de encalado. La función principal de los materiales de encalado es la eliminación de cationes formadores de ácido como el H+ y Al3+. Los bicarbonatos producidos por la reacción entre materiales encalados con dióxido de carbono y agua son capaces de realizar esta función. Las empresas que suministran materiales de encalado deben cumplir ciertos criterios para garantizar eficacia del producto. El valor neutralizante efectivo es uno de esos criterios que prueba la efectividad de los materiales en neutralizar la acidez. El Equivalente de Carbonato de Calcio o CCE determina la pureza de los productos químicos en uso. Un aumento en el CCE aumenta efectivamente el poder de neutralización de la lima. El tamaño de los materiales de encalado también es uno de los criterios. La lima fina proporcionará más manejo efectivo al reaccionar rápidamente en el suelo; pero la cal gruesa tardará más en reaccionar completamente y permanece en el suelo durante mucho tiempo.
La cal comercial es una mezcla de partículas de diferentes tamaños cal para proporcionar un aumento repentino del pH y regular este aumento durante un período de tiempo más largo.
Suelos alcalinos:
La acidificación del suelo alcalino se puede lograr mediante enmiendas de azufre en el suelo. El azufre elemental tras la oxidación por microbios produce sulfato (SO 2- 4 ) y H+ iones, que causa disminución del pH. La adición de sulfatos de hierro y aluminio en el suelo también parece funcionar como Fe3+ y Al3+ son cationes ácidos. Las enmiendas son específicas para el tamaño de partícula, la tasa de oxidación de los productos químicos como, así como las condiciones originales del suelo como el pH, la capacidad amortiguadora, etc. Fertilizantes de amonio y orgánicos del suelo.
La materia también acidifica el suelo a través de la producción de H+ iones. La adición de yeso (CaSO4.2H20) es también una práctica de uso común.
Conclusión
El pH del suelo proporciona una medida de la acidez y alcalinidad del suelo. Un efecto imperativo sobre el estado de los nutrientes del suelo y la disponibilidad de estos nutrientes se puede observar a diferentes niveles de pH. Algunos factores relevantes que impactan el pH del suelo son los materiales parentales del suelo, el contenido de materia orgánica y su descomposición, los factores climáticos y prácticas de uso de la tierra. Además, el intercambio de iones entre la solución del suelo y las plantas juega un papel importante en la liberación de cationes / aniones que juegan un papel fundamental en el mantenimiento del pH del suelo. Manejo de suelos para mantenimiento la alcalinidad o acidez con la ayuda de ciertas herramientas y productos químicos deben considerarse para una adecuada disponibilidad de nutrientes esenciales para las plantas, como así también la ayuda de equipos que nos ayuden a controlar los nutrientes y pH del suelo.
Hanna Instruments dentro de la amplia gama de equipos que maneja, recomienda los siguientes equipos para la medición de pH y nutrientes en suelo, portátiles y de mesa como el Tester de pH/TDS/Conductividad rango alto HI 98130, el Medidor portátil de pH directo en suelos HI 99121 o el HI 98168 Medidor Profesional Portátil de pH para Suelos línea GroLine, en cuánto medición de nutrientes se recomienda el HI 83325 Fotómetro Multiparámetro para Análisis de Nutrientes y Medidor de pH.
Referencias
-
Cresser.J, Killham, N., Edwards, J., (1993). Química del suelo y su aplicación, Cambridge, págs. 65-68.
-
Fernández, FG y Hoeft, RG (2009). Manejo del pH del suelo y los nutrientes de los cultivos. Manual de -agronomía de Illinois, 24, 91-112.
-
Havlin, JL, Tisdale, SL, Nelson, WL y Beaton, JD (2016). Fertilidad del suelo y fertilizantes.
-
McCauley, A., Jones, C. y Jacobsen, J. (2009). PH del suelo y materia orgánica. Módulo de gestión de nutrientes, 8(2), 1-12.
-
Responsable de nutrientes. 1996. Foco en pH y cal. Nutriente Manager Vol 3, No. 2. College Park, MD
-
Castellanos, Jz 2000. Manual de interpretación de análisis de suelos y aguas. Segunda edición. Guanajuato México .226p
-
Osorio N.W.2012 pH del suelo y disponibilidad de nutrientes. Rev. manejo integral del suelo y nutrición vegetal 1(4) :1-4 p
-
Radulov, I., Berbecea, A., Sala, F., Crista, F. y Lato, A. (2011). Influencia de la fertilización mineral en el pH del suelo, la capacidad de intercambio catiónico y el contenido de nutrientes.
-
Revista de investigación de ciencias agrícolas, 43(3), 160-165.
-
Roques, S., Kendall, S., Smith, K., Newell Price, P. y Berry, P. (2013). Una revisión de los requerimientos de nutrientes NPKS de los cereales y la colza del Reino Unido Research Review No. 78.HGCA, Kenilworth
-
Suelo franco limoso alcalino de Arkansas. Revista de la Sociedad de Ciencias del Suelo de América, sesenta y cinco(1), 239-243.
-
Agrícola y manejo del suelo. FGV-00246A. [Disponible en línea] http: // www. uaf.edu /coop-ext /. Consultado Feb, 17, 2003.
